服务查询


新闻资讯
微孔材料成员之一:应用广泛的分子筛
分子筛的广泛应用,在于它具有优异的性能。为了深刻了解这些性能,就必须弄清分子筛的结构,而深入研究分子筛的结构与性能,反过来又将进一步促进它的应用和发展。
分子筛是一种晶体硅铝酸盐,因而,可以应用X-射线衍射进行结构分析。通常合成分子筛是10μ以下的粉末,在使用粉末衍射法进行测试时,对于对称性较差的沸石类型,指标化及搜集强度的工作都十分困难,因此,到目前为止,仅确定了四十多种沸石的结构,还有一半左右尚未测定出来。
倘若能够得到较大的沸石单晶,采用X-射线衍射的单晶转动法更为有效。较大的A型分子筛单晶可由种子晶体的再结晶得到。用X-射线衍射的单晶转动法,不仅可在指标化之前,引出晶胞参数,确定骨架结构,而且还可以推定出非骨架原子(或离子)和分子和位置。
每一种分子筛都有特征的X-射线粉末衍射图样,因此由衍射图样的比较,可以确定沸石的类型。非晶态度的凝胶不产生衍射,故X-射线分析也可以用来观察分子筛结晶的情况,混和物的衍射图样,由各组分的粉末线迭合而成,并且衍射强度随含量而变化。所以X-射线衍射也用以确定分子筛的纯度。
现在又有一种新的红外光谱法测定分子筛的结构。通过测定已知结构分子筛的红外光谱,找出普带的特征频率与骨架结构基团间的关系,进而测定未知结构的光谱,推导出骨架结构。一般采用频率1300-200厘米-1的红外线。因为这一范围包含着(Si,Al)O4四面体的基本振动,反映出骨架结构的特征。目前,红外光谱已用于测定沸石骨架的结构类型,结构基团、骨架的硅铝组成,热分解过程中结构的变化和脱水、脱羟基过程中阳离子的迁移等。
在分子筛的应用中,表面性质十分重要。借助红外光谱,我们可以更透彻地了解沸石的表面性质以及在各种处理中的变化,如根据吸附分子引起的光谱变化,就可知道沸石表面与吸附分子相互作用,吸附分子的位置以及催化活性和表面性质的关系等。由于红外光谱的高度灵敏性,沸石结构的微小变化都在光谱中得到反映。
其他的物理测试技术如紫外光谱等也可以帮助确定分子筛的结构,但目前主要采用的是X-射线衍射和红外光谱法。
沸石A、沸石X、沸石Y和丝光沸石应用最广,对它们的结构和性能的研究也最为深刻。
一、分子筛结构概述
分子筛是一类具有骨架结构的硅铝酸盐晶体,晶体内的阳离子和水分子在骨架中有很大的移动自由度,可进行阳离子交换和可逆地脱水。
分子筛的化学组成可用以下实验式表示:M2/nO·Al2O3·xSiO2·yH2O
M是金属离子,n是M的价数,x是SiO2的分子数,也是SiO2/Al2O3的分子比,y是水分子数。
上式可以改写成Mp/n[(AlO2)p()q]yH2O
P是AlO2分子数,q是SiO2分子数,M,n,y同上。由上式可以看出:每个铝原子和硅原子平均加起来都有二个氧原子,若金属原子M的化合价n=1,则M的原子数等于铝原子数,若n=2,则M的原子数等于铝原子数的一半。各种分子筛的区别,首先是化学组成的不同,如经验式中的M可为Na、K、Li、Ca、Mg等金属离子,也可以是有机胺或复合离子。
化学组成的一个重要区别是硅铝克分子比的不同。例如,沸石A、沸石X、沸石Y和丝光沸石的硅铝比分别为1.5-2、2.1-3.0、3.1-6.0和9-11。
当式中的x数值不同时,分子筛的抗酸性、热稳定性以及催化活性等都不同,一般x的数值越大,而酸性和热稳定性越高。各种分子筛最根本的区别是晶体结构的不同,因而不同的分子筛具有不同的性质。
二、分子筛的结构基元
分子筛最基本的结构单位是硅氧和铝氧四面体。因为硅是+4价,氧是-2价,故(SiO4)四面体可在平面上表示如图1。实际上,硅原子的四个化学健在空间互成一定角度,故可用立体图表示,如图1、图2中,小黑点表示Si原子,周围的大圆圈表示氧原子,显示了氧的原子体积比硅大。由于每个氧原子为邻二个四面体所共用(称氧桥),因此,硅和氧的化合价都得到满足,四面体间通过氧桥相应连接,便构成链状、层状及三维的立体骨架。
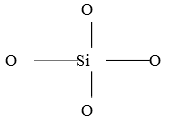
图1
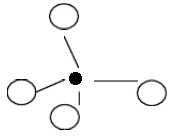
图2
在AlO4四面体中,因为铝是+3价,故四面体带有负电荷,图1和图2中金属离子用以保持电性中和。四面体中的硅和铝原子,通常用T表示,T—O和O—O间的距离是各不相等的,Si—O=1.61埃,Al—O=1.75埃,Osi—Osi=2.63埃,OAl—OAl=2.86埃。
三、环、笼和结构亚元
四面体通过氧桥相互连接,便形成环。由四个四面体组成的环是四元环,五个四面体组成的环中五元环。还有六元环、八元环、十二元环及十八元环等。所有的六元环可简化为六方型,每个顶角有一个T(Si或Al)原子,每条边的中央有一个氧原子。通常二个铝氧四面体不能直接相连。环的当中是一个孔,各种环的孔直径为:四元环1埃,六元环2.2埃,八元环4.2埃,十二元环8-9埃。
由于环可有不同程序的扭转,实际孔径瑟上述数据有一定出入。因此八元环,孔径不一定相等。环的孔径通常分子的大小差不多。六元环以下的孔径太小,分子钻不进去,除了离子交换之外,意义不大。由较大的环构成的沸石通道在分子筛的吸附及催化作用中是很重要的。
四面体通过氧桥连接成环,环上的四面体再通过氧桥相互连接,便构成三维骨架的孔穴(笼或空腔)。在分子筛的晶体结构中,含有许多形状整齐的多面体庞。如A形分子筛中,有β笼、α笼、γ笼,X型和Y型沸石中有β笼、八面沸石笼和六方柱笼等。
γ笼是一个立方体,由六个四元环组成,体积很小,一般分子进不到里面去。
六方柱笼是六棱柱体,由六个四元环和二个六元环组成,它的体积也比较小。
β笼也叫方纳石笼,因为方钠石结构中也有这种笼子,实际上是个削角或平切八面体,含有六个四角面,八个六角面和24个倾角。它的空腔体积为163埃3,平均直径6.6埃。β笼进一步相互连接,就可构成A型、X型、Y型分子筛的骨架。
对已知结构的沸石骨架经过仔细的分析,共发现八种(Si,Al)O4四面体的特殊排列——结构亚元。每种沸石骨架可看成是仅由一种结构亚元组成的。这里不考虑Si和Al原子的分布地。结构亚元的大小和硅酸盐阴离子相当。分子筛沸石的结构分类就是基于这些结构亚元进行的。每一类沸石都包含着共同的结构亚元,这八种结构亚元中最简单的是四元环和六元环。在其他硅铝酸盐骨架中也常常发现。
具有相同结构亚元的沸石,由于骨架铝硅的分布和阳离子位置不同,可以属于不同的沸石类型,如钙十字石、交沸石等。很大的四面体基团,象β笼等,虽然在许多情况下,可以把沸石骨架看成是由这些多面体单位构成的,但不算作结构亚元。
四、硅铝分布和同晶取代
骨架中的硅铝分布是沸石结构的一个重要方面,一些异构沸石及沸石组成的改变,显然在它们的硅铝分布方面有着重大差别。
沸石骨架中,硅和铝的四面体位置是通过测定这些原子和氧间的距离求得的,这一工作十分困难,至今只有少数沸石得到解决。看来骨架中的硅和铝的分布,至少是部分有序的。只有少数位置,即可以为硅点据,又可以为铝占据。因此,每种沸石的硅铝比总是有一定的范围。
X射线分析表明,水钙沸石和钠沸石中的硅铝分布是完全有序的。例如,在水钙沸石中,SiO4和AlO4四面体,按Si/Al=1相互交错。这些沸石处于相当稳定的状态,在较高温度下才能结晶出来。
在其他沸石中,硅铝的分布只是部分有序的,有序的程度也各不相同,有的长程有序,有的仅在很短区间内硅铝分布才有序的,即短程有序。
硅铝四面体原子可为其他原子取代,如Be,B、Ge、P、Fe等,四面体铝也可以通过水解而脱除,如通过反复的加热和酸处理,丝光沸石的硅铝比甚至可提高到600,即基本上不含铝,而仍名保持原来的晶体结构,红外光谱已经证明,在水解时有(H4O4)四面体生成。在此四面体中,O—O间的距离2.7埃,约等于通常氢键的键长。在钓烧时,H4O4四面体生成水,同时硅原子移动,占据空虚的铝中面体位置。
五、阳离子位置
由于热运动,阳离子位置的不规则性和位置的部分占据、以及骨架扭转和晶格缺陷等,常常使阳离子位置的精确测定受到阻碍,对于骨架孔穴很大的沸石,单靠X-射线衍射,往往不能确定阳离子位置,需要借助电子自旋等其他测试技术。
对于骨架孔穴很少的沸石,如钠沸石和水钙沸石等,只有一种阳离子位置,并且这种位置为阳离子完全占据。阳离子即与骨架氧键合,又与水分子键合,而水分子(如在钠沸石中)也与骨架氧通过氢键键合,在这些沸石中,阳离子和水分子的位置都是完全固定的。
在骨架孔穴很大的沸石中,常有几种阳离子位置。这些位置一般仅部分地被占据,同时,阳离子更多地和水分子配位。阳离子的不同分布,对离子交换、热稳定性及吸附和催化齐能都有影响。
沸石中的阳离子位置主要由下列因素决定:
1、分子筛孔穴中的吸附位能(与骨架组成有关)。孔穴中的吸附位能越大,阳离子截止趋于占据该孔穴。
2、阳离子的大小,电荷和极化率。不仅影响与骨架氧、水分子等的相互作用,而且还可能有空间位阻等复杂因素。
3、阳离子间的相互作用。
4、温度和吸着分子。由于升高温度,使热运动加快,促进了阳离子位置的转移,而水合度的增加,往往使阳离子离开骨架氧,位置变得更加不固定。如沸石ZK-5,在室温和充分水合的状态下,阳离子占据六元环外面的三次轴位置,但在150度部分脱水的情况下,这种位置完全空了。一般随着沸石硅铝比的增大,阳离子与水的作用加强,更加趋向于离开骨架氧。沸石阳离子与骨加氧之间的距离,总是大于正常的离子键长,可见,阳离子氧间还有某种程度的共价键存在。
六、水和其他吸着物
许多吸着物分子占据沸石中确定的位置,如在骨架孔穴很小的钠沸石,水分子的位置是完全确定的,在菱沸石中的卤素原子也有类似的情形。然而,在具有很大孔穴的沸石中,除了一些靠近骨架原子的吸着物外,水和其他分子的位置都是不固定的,可以把吸着物想象为在沸石内表面形成许多层。第一层的分子被强烈地吸着,随着层数的增加,越来越不受表面作用力的影响。如在八面沸石中,单位晶胞可容纳260个水分子,近于孔中心的分子与骨架的键合力很小。对于非极性分子,这种作用力就更小,位置就更加不固定。但是,对于象Br和I2这样的大分子,即使在最大的孔道中,也只能形成1-2层。因此,在键合力的类型相同的情况下,它们的位置就比小分子固定得多。沸石吸着水和其他分子的结果,常常会使骨架变形。如菱沸石的骨架,就很容易变形。可逆扭转的程度也有差别。八元环上氧原子可移动达0.5埃,因而,八元环的形状随着吸着分子而发生显著变化。A型、X型和Y型等分子筛的骨架不易变形。吸着分子吸引起骨架氧的移动,最大不超过0.1埃。菱沸石和相应的A型分子筛的主通道都由八元氧环构成,它们的不同吸附性质,除了与结构有关外,看来也受这种变形的影响。
有些沸石,特别是层状结构的沸石,在脱水时骨架崩溃。沸石中的可交换阳离子,常常因吸着分子而移动。在菱沸石中,这种移动特别大,在5A分子筛中,吸着物XE、KR—I2—SO2—H2O。由于它们与阳离子的作用依次增强,使阳离子移向孔穴。
在所有被吸着物中,水与可交换阳离子的作用最强。但这并不是说,水分子可以进入到沸石很小的狭缝中去。在水合型沸石中,可交换阳离子至少与一个水分子结合。
吸着物分子除了与可交换阳离子相互作用外,还与骨架氧作用。在吸着水的情况下,总伴有氢健的生成,而不饱和烃能较饱和烃更牢固地为分子筛所吸着,这里除了与阳离子的作用外,烃类的氢原子与骨架氧的相互作用也是重要的因素。
在沸石骨架中,由于硅铝原子的不同分布,氧原子处于不同的立体化学状态,因此,不同空间位置的位能是不同的,分子筛的起始吸附热很高,可见,最初吸附的分子占据高能量的位置。
此外,由于堆积缺陷和骨架的扭转,使得沸石的结构变得更加不规则。堆积缺陷往往造成沸石自由孔径的缩小,而扭转不损害分子筛的性质。
